Diopside - Anortite
Diagramma Isobarico suddiviso in tre parti principali:1) campo del solo liquido
2) campo liquido + solido
3) campo del solo solido
La curva che separa il campo del liquido dalle zone liquido + solido è detta curva del liquidus. In questo diagramma si hanno due curve, una per il diopside e una per l’anortite. Su queste curve si ha saturazione di diopside o anortite, e l’abbassamento della temperatura porterà alla cristallizzazione di diopside o anortite.
Le due curve hanno un punto di incontro, detto punto Eutettico (E), in questo punto si ha simultanea cristallizzazione di An e di Di; Il punto eutettico giace sulla linea del solidus, al di sotto della quale tutto il sistema è solido.
All’interno dei due campi L+An e L+Di è possibile ricavare in maniera immediata la composizione delle fasi in equilibrio e la loro percentuale. La composizione delle fasi è determinabile tracciando una retta orizzontale, passante per il punto considerato, fino a intersecare la curva del liquidus, a questo punto si traccia la perpendicolare all’asse x e si ricava la composizione del liquido in equilibrio, con An o Di, per il punto considerato.
Consideriamo la cristallizzazione di un liquido con composizione 18% An-82% Di.
Fino a che il punto non incontra la curva del liquidus il sistema è totalmente liquido; alla temperatura di 1360°C il punto incontra la curva del liquidus e si ha la formazione del primo cristallo di Diopside (Immagine 1).
Man mano che la T si abbassa avremo la formazione di cristalli di Diopside, questo ha un effetto sulla composizione del liquido, che man mano si arricchisce nel componente Anortite. La composizione del liquido si "muove" lungo la curva del liquidus (immagine 2), e man mano si avvicina alla composizione Eutettica (più ricca in An rispetto al punto di partenza).
La cristallizzazione di Diopside procede fino alla Temperatura di 1280 °C, temperatura in cui si raggiunge il punto Eutettico (Immagine 3).
In E al solido Di si aggiunge il solido An, che cristallizza simultaneamente. La composizione del liquido rimane costante e la T potrà diminuire solo quando una delle fasi scompare. Nel caso in esame (temperatura discendente) la fase destinata a scomparire è quella liquida. Scomparsa l’ultima porzione di liquido, il sistema è libero di "muoversi" e otterremo un solido composto da 18% An-82% Di.
Il caso preso in esame prevede che si abbia un continuo equilibrio tra cristalli e liquido (Cristallizzazione all’equilibrio), ma in natura è estremamente improbabile una situazione del genere.
Spesso si ha invece una cristallizzazione frazionata, in cui una delle fasi è rimossa meccanicamente; questo può avvenire nel caso in cui si abbiano cristalli più densi del liquido, che tenderanno ad affondare verso le porzioni più basse della camera magmatica, separandosi dal liquido originario. Oppure se si hanno cristalli più leggeri del liquido questi tenderanno a flottare verso l’alto.
La cristallizzazione all’equilibrio e la cristallizzazione frazionata sono due estremi di un processo molto complesso, nei sistemi naturali si ha comunemente una gradualità tra i due processi. La cristallizzazione frazionata inoltre non avviene continuamente ma può avvenire in step successivi. Ad esempio nel caso descritto prima, potremmo avere che la cristallizzazione frazionata avvenga a metà del processo di cristallizzazione. Questo ha un importante effetto sul sistema.
Se ad esempio si ha la rimozione dei cristalli precedentemente formatisi, quello che resta è solo il liquido residuale, che costituirà un nuovo punto di partenza della cristallizzazione, nuovo punto più vicino alla composizione Eutettica.
.jpg)
Immagine 1 Si ha la formazione del primo cristallo di Diopside.
.jpg)
Immagine 2 47% di Dipside. Notare come è cambiata la composizione del liquido al procedere della cristallizzazione.
.jpg)
Immagine 3 57% di Dipside. Il liquido raggiunge la composizione Eutettica.
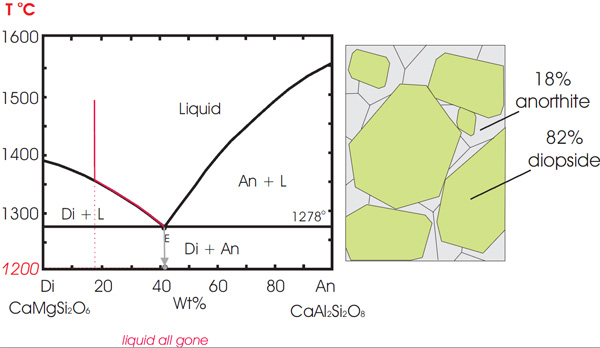
Immagine 4 Raggiunto il punto Eutettico compare l'Anortite.
Bibliografia
Le informazioni contenute in questa pagina sono tratte da:
• Anthony. R. Philpotts And Jay. J. Ague: Principles of Igneous and Metamorphic Petrology.
